益普生罕见病治疗药物奥德昔巴特胶囊在华获批
上海2024年12月4日 /美通社/ -- 2024年12月04日,全球特药领域生物制药公司益普生(Euronext: IPN; ADR: IPSEY)宣布BYLVAY, Odevixibat capsules(中文:蓓尔唯,奥德昔巴特胶囊)于12月1日经中国国家药品监督管理局正式批准,用于治疗≥6月龄的进行性家族性肝内胆汁淤积症(PFIC)患者的瘙痒[1]。此前,在先行先试政策下,奥德昔巴特在海南博鳌乐城医疗特区先行落地,此次正式获批标志着PFIC治疗领域取得重大进展,BYLVAY将为更多患者带来全新治疗选择,切实提升患者用药可及性。
进行性家族性肝内胆汁淤积症(PFIC)是一类罕见的常染色体隐性遗传病,发病率在(1~2)/10万[2],被列入《第一批罕见病目录》[3]。PFIC 常发生在新生儿期或者 1 岁以内[4],临床表现主要包括黄疸、瘙痒、血清胆汁酸(SBA)值升高、吸收不良和发育不良等,严重影响生活质量,并可能发展为终末期肝病,需要进行肝移植[2]。奥德昔巴特是全球治疗进行性家族性肝内胆汁淤积症的靶向药,2021年经欧洲药品管理局(EMA)批准,可用于治疗6个月及以上的PFIC患者[5]。作为一种可逆、强效、选择性的回肠胆汁酸转运蛋白(IBAT)抑制剂,奥德昔巴特可通过抑制回肠远端胆汁酸的再摄取,增加胆汁酸通过结肠的清除,降低血清中胆汁酸的浓度[1],减轻患者的瘙痒症状[6]。
复旦大学附属儿科医院传染感染科主任王建设教授表示:“PFIC是一类罕见的进行性胆汁淤积性疾病,可导致患者死亡或需要肝移植才能长期存活。PFIC引起的瘙痒严重影响患儿生活质量。目前对PFIC及其引起的瘙痒缺乏满意的治疗手段,没有经过批准的针对性药物,导致临床医生在管理PFIC患者时面临极大挑战。奥德昔巴特的获批将为PFIC患者带来了新的治疗选择,对于针对性治疗和缓解症状具有重要意义,期待能够让更多PFIC患儿有药可医,改善患儿的生活质量。”
益普生中国总经理Guillaume DELMOTTE表示:“作为一家专注于罕见病领域的全球生物制药公司,秉承‘聚焦、共赢、服务患者与社会'的使命,益普生致力于将前沿创新药加速引入中国市场,持续改善药物可及性。受益于国家对于儿童用药研发和审评的支持,奥德昔巴特被国家药品监督管理局药品审评中心纳入优先审评,加速获批进一步保障了患儿的用药可及性,提升PFIC患者长期治疗的便捷性。益普生也将继续支持患者亟待满足的临床治疗需求,这也是我们一直努力的目标。”
- 新华丝路:长江文化艺术季在中国湖北宜昌闭幕
- 量子之歌使命愿景全新升级:Live Better,Live Longer
- 欧姆龙自动化亮相2024工博会:聚数智低碳之力,启工业发展新航
- 医药行业如何拥抱数字化?从技术到场景创新的深度解析
- 2024上海国际养老服务产业高峰论坛报名启动
- 长风万里阔,奋楫启新程:第十二届陆道培血液病学术论坛盛大开幕
- Airbnb爱彼迎发布2024年第一季度财报
- 耀华北京校区在国际赛事中斩获佳绩,学术成就闪耀全球舞台
- 三安集成卫星通信滤波器组合实现量产,助力空天地一体化网络建设
- AUTOMOBILI PININFARINA 打造定制版双子超跑
推荐
-
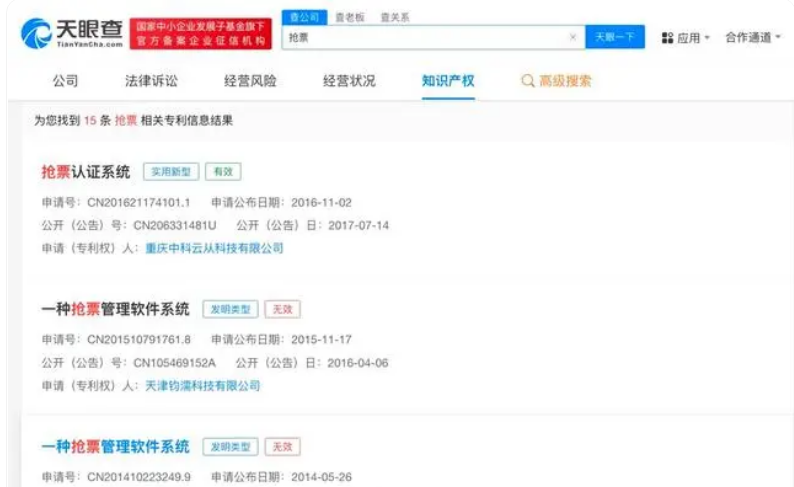 春节将至,抢票再次成为广大网友关注的热门话题
春节将至,抢票再次成为广大网友关注的热门话
财商
春节将至,抢票再次成为广大网友关注的热门话题
春节将至,抢票再次成为广大网友关注的热门话
财商
-
 娃哈哈这艘商业巨舰将驶向何方,我们试目以待
2月25日,娃哈哈集团在官网发布讣告,娃哈哈创
财商
娃哈哈这艘商业巨舰将驶向何方,我们试目以待
2月25日,娃哈哈集团在官网发布讣告,娃哈哈创
财商
-
 为何娃哈哈纯净水线上会卖断货?
随着网络上关于娃哈哈和农夫山泉之争的持续
财商
为何娃哈哈纯净水线上会卖断货?
随着网络上关于娃哈哈和农夫山泉之争的持续
财商
-
 我们时常把创业想得太过简单,认为获得成功轻而易举
我们时常把创业想得太过简单,认为获得成功
财商
我们时常把创业想得太过简单,认为获得成功轻而易举
我们时常把创业想得太过简单,认为获得成功
财商
-
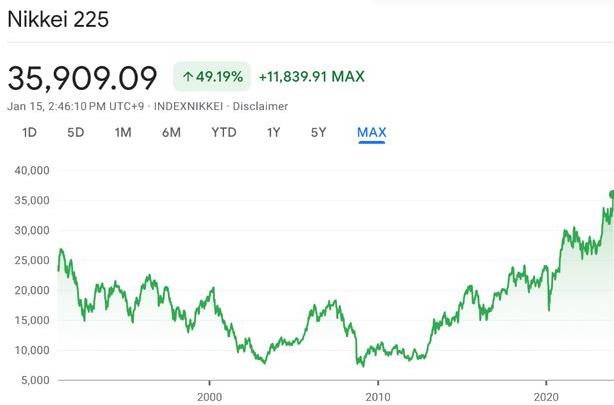 日股盘中再破34年新高,今年还涨得动吗?
今年日股开局强势,1月5日以来开启连涨行情,日
财商
日股盘中再破34年新高,今年还涨得动吗?
今年日股开局强势,1月5日以来开启连涨行情,日
财商
-
 广东省药监局调研恒昌医药集团,聚焦药品流通产业高质量发展
日前,广东省药品监督管理局党组成员、副
财商
广东省药监局调研恒昌医药集团,聚焦药品流通产业高质量发展
日前,广东省药品监督管理局党组成员、副
财商
-
 供应“安全感”超过红海“危机感”?欧洲天然气价格大跌
虽然冬季极寒天气来临,而且卡塔尔似乎已经暂
财商
供应“安全感”超过红海“危机感”?欧洲天然气价格大跌
虽然冬季极寒天气来临,而且卡塔尔似乎已经暂
财商

