余科达教授解读:CBCS&CSOBO乳腺癌指南“小红书”更新,晚期TNBC新增中国原创TROP2 ADC
编者按:三阴性乳腺癌(TNBC)被称为“最毒”的乳腺癌亚型。近年来,国内外TNBC系统治疗领域取得不少突破性进展,其中不乏中国原创的诊疗新理念和新方案。例如,TNBC复旦分型逐步深化并进入临床研究验证阶段,而中国原创的新型TROP2 ADC芦康沙妥珠单抗也为TNBC带来新的治疗选择,并被纳入《CBCS&CSOBO乳腺癌诊治指南与规范精要本(2025年版)》[1](以下简称“小红书”)中。《肿瘤瞭望》在第十六届上海市乳腺癌专业研讨会暨上海市抗癌协会乳腺癌专业委员会年会上,有幸采访CBCS&CSOBO乳腺癌指南“小红书”编写组秘书长、复旦大学附属肿瘤医院余科达教授,与我们分享新版“小红书”更新的临床意义以及晚期TNBC的更新亮点。
01
《肿瘤瞭望》:余教授您好,CBCS&CSOBO乳腺癌指南“小红书”再次迎来重磅更新,请您谈谈此次更新的背景及意义?
余科达教授:过去一年,乳腺癌领域迎来了较大的发展,包括HER2阳性、激素受体阳性、TNBC的早期(新)辅助、晚期治疗等领域均有诸多突破性研究进展。如EMERALD、DESTINY-Breast06、OptiTROP-Breast01等研究带来了新的循证医学证据,为患者提供了诸多新的治疗选择。与此同时,中国有多个新型治疗药物首次获批上市,或者扩大适应症、纳入新版医保目录,提升了新药治疗的临床可及性。如芦康沙妥珠单抗(SKB264)、特瑞普利单抗等新药获批乳腺癌相关适应症;帕妥珠曲妥珠单抗皮下制剂、德曲妥珠单抗(T-DXd)被纳入新版医保目录,均会对临床实践产生影响。
2025版CBCS&CSOBO乳腺癌指南“小红书”紧跟前沿并兼顾国情,结合最新的循证医学证据以及药物治疗的可及性等情况,对乳腺癌的治疗方案进行分层、分类介绍,使其更加贴近我国乳腺癌诊疗的临床实践。此外,“小红书”在内容、形式、传播等方面进行创新,旨在提升使用效率。例如便携式的“口袋书”设计,可以方便医生随时查找应用;与此同时,我们还开发了小程序、超链接等线上阅读版的“小红书”,方便大家“一键查找”。随着人工智能(AI)和互联网技术的发展,未来的“小红书”将有更多“科技元素”,使得指南规范更具互动性和真实性。
02
《肿瘤瞭望》:在邵志敏教授的引领下,TNBC复旦分型的研究日渐深入,备受国内外专家关注。值此指南更新之际,请您概览一下TNBC复旦分型的研究进展。您认为复旦型距离写入指南还有多远?
余科达教授:2019年邵志敏教授带领团队正式提出了TNBC的复旦分型(FUSCC),基于转录组学数据分为:腔面雄激素受体型(LAR)、免疫调节型(IM)、基底样免疫抑制型(BLIS)和间质型(MES)[2]。此后我们继续丰富FUSCC分型。例如针对LAR型,2023年发表于Cell Metabolism的研究发现TNBC 中存在铁死亡敏感的LAR亚型,靶向铁死亡联合免疫检查点抑制剂是潜在治疗策略[3];针对MES型,2024年发表于Cell Reports Medicine的研究显示,肿瘤干细胞生物标志物EMSY的积累,可增加肿瘤细胞对PARP抑制剂和甲硫氨酸剥夺的敏感性[4]。
当然,临床医生更为期待的是在临床中进一步应用和验证TNBC复旦分型。为此,我们开展了FUTURE伞型研究,包括对C队列的扩展FUTURE-C-Plus研究;随后又开展了伞型随机对照的FUTURE-SUPER研究,该研究成果于2024年初发表于The Lancet Oncology。这是首次在随机对照研究中验证复旦分型,根据LAR、IM、BLIS、MES分为5个队列的一线精准治疗策略,并与当前标准化疗(白蛋白结合型紫杉醇)进行对比,结果显示精准治疗组能够显著延长PFS(11.3 vs 5.8个月,HR 0.44)[5]。
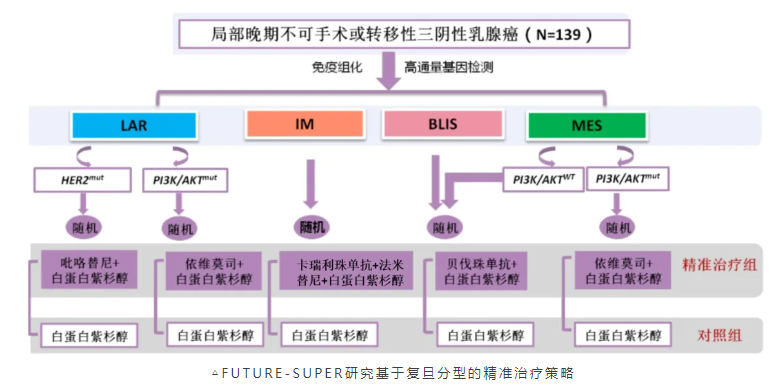
复旦分型的精准治疗取得了临床试验的突破,但距离影响指南还有较长的路要走。首先,分型的应用需要建立在规范检测普及的基础上,否则不同医院的检测结果和数据难以互认;其次,该分型涉及多种新型治疗药物,仍需开展更多大样本的、多中心的III期临床试验进行疗效和安全性验证。目前,FUTURE-SUPER拓展延伸的“2.0版”研究以及相关III期临床研究正在开展中,期待未来有更多捷报。
03
《肿瘤瞭望》:对于异质性极强的TNBC治疗,一方面是采取TNBC复旦分型这种“同病异治”的策略;另一方面则是寻找共有的靶点实施“异病同治”,比如针对TROP2靶点的治疗。在此次“小红书”更新中,TNBC治疗新增了TROP2 ADC 芦康沙妥珠单抗,您对此有何评价?
余科达教授:复旦分型或者当前大多数的精准治疗,主要基于可操作的靶点或突变。随着抗体偶联物(ADC)的更新迭代,许多新型ADC具有“超越生物标志物”的精准治疗价值,它们主要将肿瘤细胞表面蛋白作为递送和内吞药物的靶标,达到“靶向导航”的效果,但其治疗是否有效并不完全依赖靶点的表达水平。尤其针对TROP2这类广泛表达于肿瘤细胞,比如在TNBC中表达率可达90%的靶点,TROP2 ADC展现了极大的应用潜力。
戈沙妥珠单抗是全球首个TROP2 ADC,率先取得突破,掀开了TROP2 ADC治疗mTNBC的序幕。芦康沙妥珠单抗是我国自主研发的新一代TROP2 ADC,产品设计之初锚定了更好的临床获益,药物抗体比(DAR)高达7.4,且循环中稳定性较好。得益于这些药物优势,芦康沙妥珠单抗在临床试验中展现了积极的疗效和可控的安全性。OptiTROP-Breast01研究[6]显示,对于经过多线治疗的mTNBC患者,芦康沙妥珠单抗相较于化疗显著延长mPFS(6.7 vs 2.5个月,HR 0.32,95%CI:0.22~0.44,名义P<0.00001);OS数据尚未成熟,但已显示出具有显著统计学意义和临床意义的改善(HR 0.53,95%CI:0.36~0.78,P=0.0005)。同时,肿瘤客观缓解率(ORR)芦康沙妥珠单抗相较于化疗也更具优势(45.4% vs 12.0%,差异:33.1%, P < 0.00001)。在安全性方面,芦康沙妥珠单抗最常见的≥3级治疗相关不良事件(TRAE)是血液学不良反应,中性粒细胞计数减少(32% vs 47%)、贫血(28% vs 6%)和白细胞计数减少(25% vs 36%),临床易于管控。此外,需要关注口腔黏膜炎的管理,对于病人长期用药的耐受性至关重要。
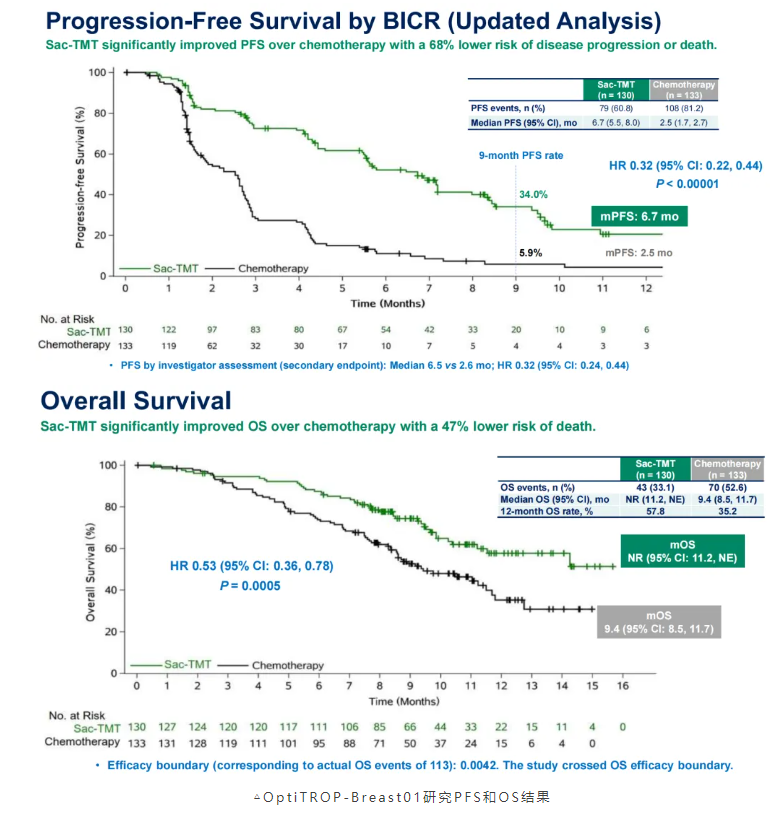
基于该研究,新版CBCS&CSOBO乳腺癌指南“小红书”在晚期TNBC二线及后线治疗的TROP2 ADC方案中,增加了芦康沙妥珠单抗。这是我国自主研发的TROP2 ADC,疗效和安全性可以媲美国外开发的TROP2 ADC。对于中国患者而言,芦康沙妥珠单抗治疗的可及性好,且展现的是中国患者数据,并且有“超越生物标志物”的精准治疗价值,“小红书”指出TROP2在大多数TNBC中呈高表达,目前不需常规检测。未来,针对TROP2耐药后的治疗选择,以及TROP2联合其他治疗的可行性,也是值得研究探讨的问题。

参考文献:
[1]中国抗癌协会乳腺癌专业委员会(CBCS)和中华医学会肿瘤学分会乳腺肿瘤学组(CSOBO)乳腺癌诊治指南与规范精要本(2025年版)
[2]Jiang YZ, Ma D, Suo C, et al. Genomic and Transcriptomic Landscape of Triple-Negative Breast Cancers: Subtypes and Treatment Strategies. Cancer Cell. 2019;35(3):428-440.e5. doi:10.1016/j.ccell.2019.02.001
[3]Yang F, Xiao Y, Ding JH, et al. Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy. Cell Metab. 2023;35(1):84-100.e8. doi:10.1016/j.cmet.2022.09.021
[4]Liu CC, Chen L, Cai YW, et al. Targeting EMSY-mediated methionine metabolism is a potential therapeutic strategy for triple-negative breast cancer. Cell Rep Med. 2024;5(2):101396. doi:10.1016/j.xcrm.2024.101396
[5]Fan L, Wang ZH, Ma LX, et al. Optimising first-line subtyping-based therapy in triple-negative breast cancer (FUTURE-SUPER): a multi-cohort, randomised, phase 2 trial. Lancet Oncol. 2024;25(2):184-197. doi:10.1016/S1470-2045(23)00579-X
[6]Binghe Xu,et al.Sacituzumab tirumotecan (SKB264/MK-2870) in patients (pts) with previously treated locally recurrent or metastatic triple-negative breast cancer (TNBC): Results from the phase III OptiTROP-Breast01 study.J Clin Oncol 42, 2024 (suppl 16; abstr 104)
- HIERTECH黑尔泰克多功能排插 创新设计与高质量塑造国货新标杆
- 【精酿啤酒设备自酿啤酒设备靠谱推荐厂家!】正麦机械设备
- 迪拜在2023年文化和创意产业外国直接投资指数中名列全球第一
- solutions by stc与Mavenir签署Open RAN协议,在沙特阿拉伯推出首个商用Open RAN
- 财伯乐&伯乐遇马税务师事务所品牌发布会圆满落幕!
- Nikkiso Clean Energy & Industrial Gases Group Announces CEO Transition July 1, 2024
- NetApp利用全新高性能系统加速关键块存储工作负载
- Bahr Transportation Transforms Operations with Descartes’ Transportation Management, Freight Visibil
- 尼尔森IQ携手世界数据实验室、SPATE发布《美业未来:全球代际消费者趋势指南》
- Sportradar Appoints Behshad Behzadi as Company's Chief Technology Officer and Chief Artificial
- 贝康医疗(2170.HK):销售收入增长46%,毛利72%,国际化布局初见成效
- 全国货运,总量第一——运满满APP荣获2024品博会“最具影响力品牌”
- 光明园迪来支招,寒假要这么安排才正确
- 合金钢C型带钢吊具带钢C型吊钩钢卷吊具C型吊具
- 2024第二季度NMN市场调研透视:全球竞争格局与未来趋势
- “同行十载·合力向新”银盛支付2024年合作伙伴大会·郑州站圆满举行
- “上海时尚科技中心”首秀,冯氏集团连续第七年参与进博
- 中信银行太原分行:零钱兑换暖人心 主动服务赢赞誉
- 广州艺术家杨学军、李雄合作的雕塑作品《广交会——来自世界的笑脸》入选五年一次的第十四届全国美术作品展览
- 现代教育产业平台:弘扬现代教育思想
推荐
-
 海南大学生返校机票贵 有什么好的解决办法吗?
近日,有网友在“人民网领导留言板&rdqu
资讯
海南大学生返校机票贵 有什么好的解决办法吗?
近日,有网友在“人民网领导留言板&rdqu
资讯
-
 新增供热能力3200万平方米 新疆最大热电联产项目开工
昨天(26日),新疆最大的热电联产项目—&md
资讯
新增供热能力3200万平方米 新疆最大热电联产项目开工
昨天(26日),新疆最大的热电联产项目—&md
资讯
-
 中国减排方案比西方更有优势
如今,人为造成的全球变暖是每个人都关注的问
资讯
中国减排方案比西方更有优势
如今,人为造成的全球变暖是每个人都关注的问
资讯
-
 大家一起关注新疆乌什7.1级地震救援见闻
看到热气腾腾的抓饭马上就要出锅、村里大家
资讯
大家一起关注新疆乌什7.1级地震救援见闻
看到热气腾腾的抓饭马上就要出锅、村里大家
资讯
-
 周星驰新片《少林女足》在台湾省举办海选,吸引了不少素人和足球爱好者前来参加
周星驰新片《少林女足》在台湾省举办海选,吸
资讯
周星驰新片《少林女足》在台湾省举办海选,吸引了不少素人和足球爱好者前来参加
周星驰新片《少林女足》在台湾省举办海选,吸
资讯
-
 看新东方创始人俞敏洪如何回应董宇辉新号分流的?
(来源:中国证券报)
东方甄选净利润大幅下滑
资讯
看新东方创始人俞敏洪如何回应董宇辉新号分流的?
(来源:中国证券报)
东方甄选净利润大幅下滑
资讯
-
 透过数据看城乡居民医保“含金量” 缴费标准是否合理?
记者从国家医保局了解到,近期,全国大部分地区
资讯
透过数据看城乡居民医保“含金量” 缴费标准是否合理?
记者从国家医保局了解到,近期,全国大部分地区
资讯
-
 国足13次出战亚洲杯首次小组赛0进球
北京时间1月23日消息,2023亚洲杯小组
资讯
国足13次出战亚洲杯首次小组赛0进球
北京时间1月23日消息,2023亚洲杯小组
资讯
-
 中央气象台连发四则气象灾害预警
暴雪橙色预警+冰冻橙色预警+大雾黄色预警+
资讯
中央气象台连发四则气象灾害预警
暴雪橙色预警+冰冻橙色预警+大雾黄色预警+
资讯
-
 抖音直播“新红人”进攻本地生活领域
不难看出,抖音本地生活正借由直播向本地生活
资讯
抖音直播“新红人”进攻本地生活领域
不难看出,抖音本地生活正借由直播向本地生活
资讯

